蔡司Lattice Lightsheet 7
活细胞的长时间体积成像
蔡司Lattice Lightsheet 7使光片荧光显微技术可用于亚细胞分辨率下的活细胞成像,同时还可使用标准样品载具。借助该自动化且易用的系统,可以实现在数小时到数天内对亚细胞结构的动态变化进行体积成像,并在整个过程中提供出色的保护,避免光毒性对样品的影响。该系统能够以丰富细节探索生命动态变化的过程——轻而易举,超乎想象!
可直接在标准样品载具上检查活体样品
可在长达数小时、甚至数天内观察亚细胞层面的生命动态
以真实比例显示三维细节
不错过盖玻片样品动态变化的任何细节
可以把全部注意力放在您的实验上
晶格光片技术,人人皆可用
高分辨率的低光毒性光片成像对于研究亚细胞过程的重要性不言而喻。有了Lattice Lightsheet 7,蔡司便可轻松利用这项先进技术的优势。无需调整常用的样品制备,您便可直接在用于共聚焦显微镜的标准样品载具上观察活体样品。系统将自动执行复杂的校准流程,这样您就可以把全部注意力放在您的实验上。
几乎没有光毒性和光漂白
您想观察亚细胞分辨率下的生命动态,以研究超细微结构如何随时间的推移而变化,但您的传统成像系统很快就会达到它们的极限,因为其侵害性过强,会破坏您正在观察的样品。相反,蔡司Lattice Lightsheet 7提供了晶格结构光,可以自动适应您的敏感样品,从而大幅度减少光漂白和光毒性,使您的实验得以持续数小时甚至数天。受控的培养环境和集成的自动加水机制使您可以进行无人值守的长期实验。
高速体积成像
蔡司Lattice Lightsheet 7的快速图像采集每秒可进行多达三次的体积扫描。全样品体积动态成像如此高的时间分辨率意味着您不会再错过盖玻片上任何值得关注的情况。沿X、Y和Z轴的近各向同性分辨率为您提供了样品的三维图像,以真实比例揭示了结构细节。快速激光切换可以同时使用多达三种颜色进行成像,并尽可能降低颜色串扰。
产品背后的科技
晶格光片显微技术的原理
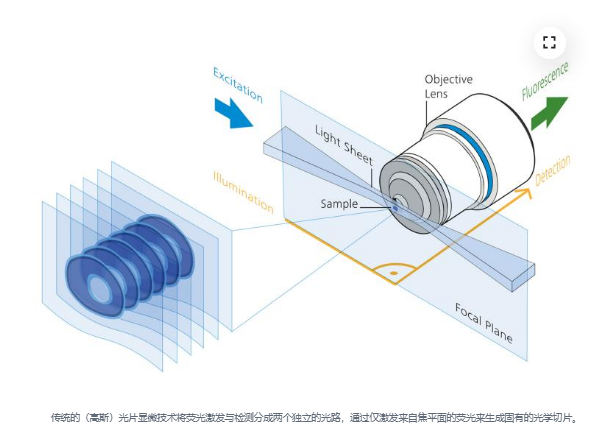
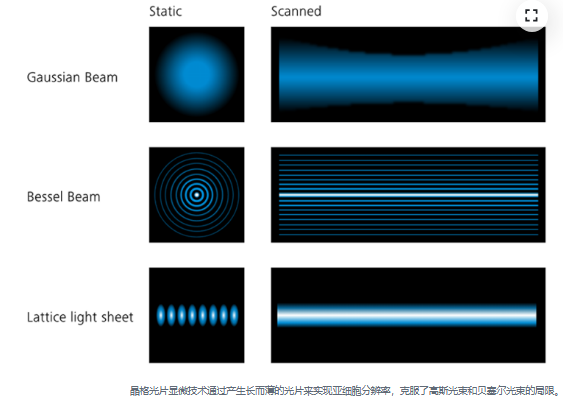
光片显微技术
通常(也称为高斯光片显微技术)以其低光毒性成像条件和出色的成像速度而闻名。突破性的激发和检测去耦化概念可以仅对检测物镜焦平面内的样品进行照明。根据样品移动片层并在每个焦平面上记录一张图像,即可在不暴露非焦平面样品的情况下获得体积数据。
晶格光片显微技术
将光片显微技术与共聚焦范围内近各向同性分辨率的优点集于一身。先进的光束塑造技术创造了晶格状光片,此光片比标准高斯光片要薄得多,在相似的成像速度下可获得更高的分辨率。我们使用空间光调制器(SLM)创建光片的晶格结构,然后通过扫描装置投射到样品上。扫描装置对晶格结构进行抖动处理后,即可创建一个平滑的光片。
蔡司实现晶格光片显微技术
在开发Lattice Lightsheet 7的过程中,蔡司特别对易用性和与传统样品制备技术的兼容性予以了关注。倒置配置是标准样品载具可用于高分辨率显微技术的重要先决条件。该配置带来的挑战主要是折射率不匹配,因为荧光从样品中发射,经过水相细胞培养基、倾斜的玻璃盖玻片和水介质,然后进入检测物镜。
优质的蔡司光学元件
检测光路中特殊的蔡司专利光学元件可以补偿折射率的不匹配,使您能够像使用共聚焦显微镜一样轻松、快速地对样品进行成像。
产品性能
标准样品载具的使用
载玻片
35 mm培养皿
腔室载玻片
多孔板
快速、低光毒性的样品定位
借助集成的透射LED和斜照明检测(其提供类似于DIC的衬度),您可以轻松定位样品。如有必要,您可将白色透射LED变为红色透射LED,以获得光毒性更低的照明。在长期观察过程中,您可以选择加入透射光照明。
自动样品水平调整
专为此系统设计的5轴载物台不仅可以沿X、Y和Z轴移动,还可以在X和Y方向上以高精度倾斜,补偿载体尺寸或样品位置的微小偏差。样品水平调整可自动进行,免除了繁琐的手动操作程序。
所有光学元件的自动校准
为了获得理想的成像效果,晶格层光显微镜必须适应每个样品。因此,蔡司已经实现了所有光学元件的自动校准,以避免耗时的手动调整。激发光路的创新设计能够快速切换激光,而无需对SLM重新编程。这样几乎可以同时采集多通道数据集,让您不会错过样品中出现的任何情况。
双相机配置让时间分辨率提高一倍
创新设计的激发光路可实现多条激光同时激发样品。与两台滨松ORCA-Fusion相机结合使用可实现真正的两个通道同时成像,这对于一系列的应用至关重要,例如比率实验。双相机配置可以实现在每台相机前使用单色带通滤光片,更大限度地减少串色,从而在保证高速成像的同时获取高清的图像。
无人值守的长期实验
培养装置: 集成的培养系统在不同的环境条件下提供长期稳定性。显微镜自动控制和监测温度、CO2和O2水平以及湿度,以在整个实验过程中保持样品的活性。带玻璃窗的盖子可以助您便捷地观察样品,以便在实验运行期间对其进行检查。
自动加水: 对系统灌注以排出空气,然后会自动释放适合您实验需求的介质。介质的补充由软件控制,因此您不必担心会干扰图像采集。储集器受到保护,不受光照影响,以防细菌生长。物镜受到保护不会被浸湿,因此即便使用了过量的介质也可保持干燥。
典型应用
蔡司Lattice Lightsheet 7应用案例
动态核纤层蛋白B1
核纤层蛋白B1位于核膜上,在有丝分裂过程中参与核膜的分解和重组。在细胞周期不同阶段的有丝分裂过程中,许多不同类型的细胞经常会形成“核内陷”。核内陷可以表现为从核膜延伸并穿过细胞核的管状结构。这些独特的结构虽然经常出现,但迄今为止,大多数研究都在固定细胞中进行。因此,尽管已经存在很多假说,这些结构的功能在很大程度上仍处于未知状态。
该数据集由西雅图Allen Institute for Cell Science的细胞系记录:人工诱导多能干细胞,其内源性表达mEGFP标记的核纤层蛋白B1(AICS-0013)。过夜的实验记录了近8小时,每1.5分钟成像一个体积。在整个持续时间都可以观察到正在进行有丝分裂的细胞。在整个细胞周期中,可以清晰地观察到大多数细胞中核内陷的形成和动态。
低光毒性的照明对于有丝分裂的成像至关重要,因为该过程十分精密且光敏。为了防止受损DNA的复制,一旦有任何来自激发光的损伤,细胞的有丝分裂就会停止。要在更长的时间内对有丝分裂事件进行成像,则需要低光毒性的Lattice Lightsheet 7以及非常稳定的系统。快速的体积成像与近各向同性的分辨率相结合,可以从各个角度观察样品,检测独特亚细胞结构的每一个细节。蔡司Lattice Lightsheet 7是进行此类极具挑战实验的好工具,它让之前不可能实现的应用变为现实,且具有易用性,让您可以轻松将其用于研究。
最高体积速度下的亚细胞动态
COS-7细胞
瞬时转染Calnexin-mEmerald和EB3-tdTomato的COS-7细胞。EB3标记微管生长端,对于微管动力的调节必不可少。钙连蛋白是内质网(ER)的一种蛋白质,蛋白质在此合成。连续成像24分钟,每7秒拍摄一个体积。成像体积:118 × 113 × 22 μm³。240,600张图像,300个时间点的401个体平面。
U2OS细胞动态
时间序列视频显示了使用肌动蛋白GFP(细胞骨架,青色)来稳定标记的U2OS细胞动态,并使用了MitoTracker™ Red CMXRos(线粒体,绿色)和Draq 5(细胞核,品红色)标记细胞。
U2OS细胞的有丝分裂
在连续成像过程中,表达Lifeact-tdTomato的U2OS细胞正在进行有丝分裂。最大强度投影。对细胞连续成像超过2.5个小时;每2.2秒一个体积(113 × 90 × 11 μm³)。共记录了1,404,000张图像;4,000个时间点的351个体平面。
对囊泡进行三维跟踪
瞬时转染mEmerald-Rab5a和Golgi7-tdTomato的Cos7细胞。Golgi7是一种与高尔基体和高尔基体囊泡相关的蛋白质。Rab5a是一种早期的胞内体标记物。以近各向同性的分辨率对囊泡进行三维跟踪。在arivis Vision4D®中进行跟踪。
T细胞表达Lifeact-GFP
实现更加可靠的共定位研究
您在开展共定位研究时不能存在丝毫串扰,因为这会让您无法确信所观察的共定位结果是否真实。但使用单色带通滤光片则意味着在成像时需要切换滤光片,从而减慢采集速度,导致重叠的结构之间发生显著偏移,因此无法确定共定位结果和观察到的相互作用是否准确。双相机配置解决了这一难题,让您对采集的数据和所得结果充满信心。
U2OS细胞用MitoTracker Green(绿色)和MitoTracker Red CMXRos(品红色)染色。这两种染料定位于线粒体,因此应始终共定位。左侧:单相机配置。由于两个通道之间的记录时间有延迟,导致两种标记结构发生空间位移。右侧:双相机配置。这些结构完全重叠,与预期结果一致。双相机可采集到60个时间点,而单相机在同等时间内只能采集16个时间点。
比率实验
通过对MitoTracker Green和MitoTracker Red CMXRos的荧光强度比进行分析来研究线粒体膜电位。其中MitoTracker Red CMXRos的摄取依赖膜电位;而MitoTracker Green与线粒体膜电位无关,是线粒体聚集的一种测量方法,可用作内部参考。因此,两种染料的荧光比率是线粒体膜电位的相对量度。
初期生命发育
卵母细胞
活小鼠卵母细胞停留在中期II
活小鼠卵母细胞停留在中期II,线粒体(青色)、微管(品红色)和染色体(黄色)染色。样品由德国哥廷根马克斯普朗克研究所的C. So提供。
小型进化生物的生命发育
斑马鱼、秀丽隐杆线虫、果蝇
斑马鱼胚胎:运输mRNA分子
在arivis Vision4D®上跟踪运输mRNA分子。斑马鱼胚胎的运动首先使用核参考轨迹进行校正,然后对单个mRNA分子进行长时间跟踪,得出速度和方向性等统计结果。样品由瑞士洛桑联邦理工大学的Andrew Oates教授提供。
DeltaD-YFP转基因斑马鱼胚胎
DeltaD-YFP转基因斑马鱼胚胎(Liao et al. 2016, Nature Communications)。由含有内源性调控区域的转基因驱动的融合蛋白,在尾芽和前体节中胚层中表达。信号在细胞皮层和与运输囊泡(绿色)对应的点状物中可见。细胞核为品红色。胚胎持续成像5分钟;每8秒一个体积(150 × 50 × 90 μm³)。
秀丽隐杆线虫胚胎,细胞核染色
秀丽隐杆线虫胚胎,细胞核染色。视频展示了胚胎的彩色深度投影。对胚胎持续成像10多分钟;每700毫秒一个体积。成像体积:115 × 50 × 30 μm³。共记录了101,000张图像;1,000个时间点的101个体平面。
果蝇胚胎
黑腹果蝇是生物医学研究等众多研究领域的模式生物。许多转基因变体可供研究人员使用。本视频展示了一个带GFP标记的果蝇胚胎随着时间推移而移动。共记录了91,100张图像;100个时间点的911个体平面。每15秒一个体积;成像时间25分钟,成像体积:300 × 455 × 145 μm3。
发育三维细胞模型
细胞球和类器官是“器官”的体外模型,它更小、更简单但易于生产。因此,对于发育生物学家来说,它是研究器官发育的宝贵对象。与通常仅包含单层细胞的细胞培养不同,细胞球/类器官中的细胞会形成三维结构,便于在三维细胞模型中进行细胞迁移和分化的检测。晶格光片显微技术使对有机体发育和自组织进行成像成为现实。在这里,我们可以看到细胞球的三维渲染,该细胞球由表达H2B-mCherry(青色)和α-Tubulin-mEGFP(品红色)的细胞所组成。并非所有细胞都被标记。
发育中的植物和植物种子
花粉粒和花粉管
花粉管,线粒体(MitoTracker Green,绿色)和溶酶体(Lysotracker Red,红色)染色。观察花粉管从花粉粒的裂缝中延伸出来(可通过其自发荧光成像)。线粒体并未完全延申到花粉管的最顶端,而是在顶端前几微米处停止。使用arivis Vision4D®进行数据集渲染。
相关应用
使用荧光显微技术进行细胞成像
借助可平衡灵敏度、分辨率和荧光基团要求的不同技术,探索从宽场到去卷积、共聚焦乃至超分辨率的各种选项。
制药与生物制药行业
从科学洞察到疾病的预防、治疗和恢复
活细胞成像
除了满足您对高分辨率荧光成像的需求外,还提供以更快速度进行超低光毒性成像的技术。
深入类器官研究的三维图像分析
探索利用高级体外实验模型来超越动物模型研究的增强型图像分析实例。
生命科学研究中的晶格层光显微镜
探索来自学术研究界的最新应用实例
用于生命科学分析测试平台的成像解决方案
为您的平台配备研究社群支持技术
技术参数